Química Analítica
Aprenda como fazer uma solução a 0,1 M de HCl em seu laboratório. Ou com a Molaridade que você preferir, na quantidade exata que você precisa, sem desperdiçar e com o tipo de HCl que você comprou, ajustando a concentração para a que você possui no momento.
Exemplo 1 - Passo a passo detalhado
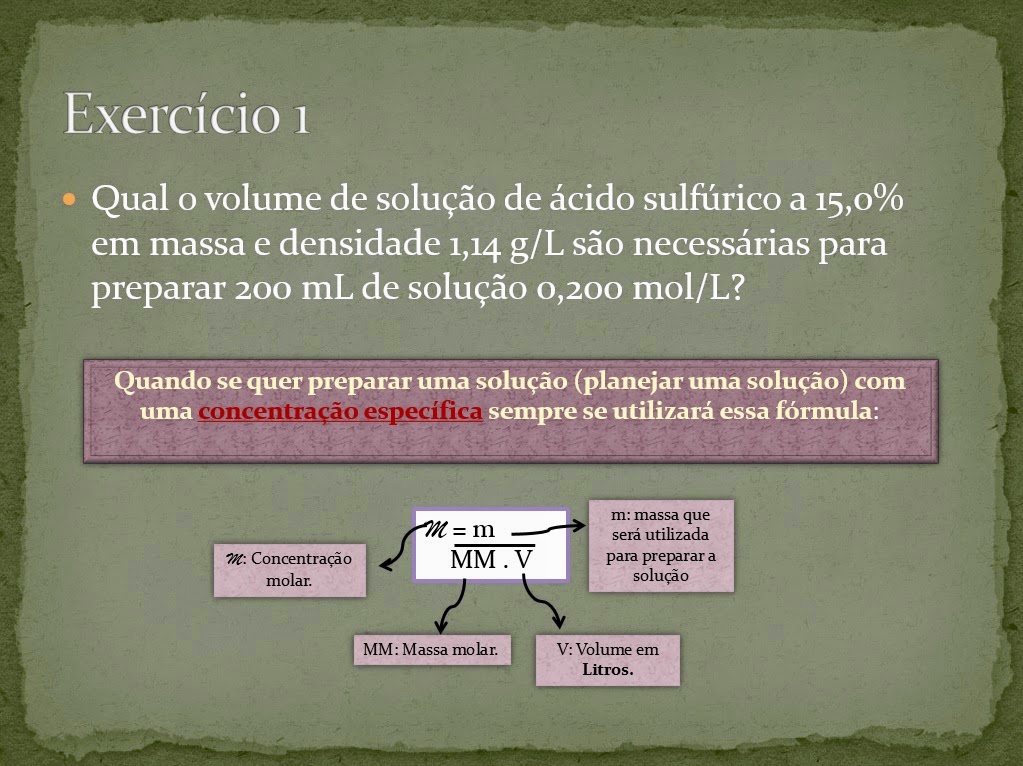
A Química Analítica te proporciona formas de preparar através de um planejamento soluções com concentração específica e na quantidade exata que você necessitará.
Para esse tipo de problema se utilizará essa fórmula acima, que te permite planejar uma solução para qualquer tipo de soluto.
Deve-se substituir na fórmula observando as unidades, como a concentração desejada (portanto a que está entrando na fórmula) está em mol/L, o volume terá que ser em litros e as unidades de massa serão em gramas.
Quanto a Massa Molar é igual a soma da massa atômica dos átomos que compõem, no caso, o ácido sulfúrico. Para isso pega-se a massa de cada um dos átomos, obviamente se multiplica ela pela quantidade de vezes que esse átomo aparece na molécula, tendo assim a massa total da molécula.
Sabe-se que 1 mol de uma molécula é igual ao valor da sua massa atômica, porém em gramas. Portanto se a molécula no caso pesa 98 u: 1 mol dessa molécula (6x10^23 átomos) irá pesar 98 g.
Então substitui-se na fórmula e acha o m, essa seria sua resposta, seria o quanto você teria que pesar na balança de ácido sulfúrico para fazer essa solução que você deseja.
Ou seja, temos somente 15 gramas de ácido sulfúrico realmente em 100 gramas da solução. Então para termos 3,92 gramas de ácido quanto da solução terá que ser pega?
Exemplo 2 - Resumo dos passos
1o passo (calcular o m real para se produzir essa solução desejada):
Substitui-se na fórmula para a achar o m real.
Substitui-se na fórmula para a achar o m real.
E então se adéqua essa massa a concentração do seu soluto:
2o passo (Corrigir pela concentração do que temos no laboratório):
Como o ácido em questão do meu laboratório é a 96%, ou seja, próximo dos 100% de pureza, a massa corrigida ficou parecida com a real que achamos com a fórmula principal acima.
Como o ácido em questão do meu laboratório é a 96%, ou seja, próximo dos 100% de pureza, a massa corrigida ficou parecida com a real que achamos com a fórmula principal acima.
3o e último passo (se o soluto da nossa solução é líquido utilizamos a densidade para saber o volume que teremos que pegar):
Como o ácido sulfúrico é líquido à temperatura ambiente, utilizamos no terceiro e último passo, a densidade para saber quanto de volume se terá aquela massa que precisamos.
Essa aula pode ser encontrada para download em: https://www.4shared.com/office/ToGOcC43ce/Qumica_Analtica.html?"> 4shared.




























0 comentários:
Postar um comentário