Introdução à Química Orgânica
Orgânicos são compostos que possuem carbono e são derivados de organismos vivos, porém também podem ser produzidos laboratorialmente através de carbonatos (CO3^2-) e cianetos (CN-), que são compostos inorgânicos (compostos que provêm de minerais).
Contudo a maneira mais fácil de obtê-los é pelo isolamento por produtos animais e vegetais. O tipo de substância da qual é mais fácil conseguir sintetizar derivados orgânicos é o petróleo e o carvão.
São materiais formados por "fósseis", restos de organismos ao longo de milhões de anos que foram depositados na crosta terrestre.
Por isso não são renováveis (não em um tempo significativo para o ser humano, nem sequer para a espécie humana que só tem 200 mil anos).
Mas do petróleo extraído, somente 10% é usado para produção química, o restante é queimado para produção de energia.
Teoria Estrutural
A teoria estrutural permite organizar e utilizar os milhões de fatos relativos aos compostos, observados entre substâncias macroscopicamente, para explicar (formular hipóteses) como é a maneira que os átomos se agrupam (reagem entre si) para formar moléculas.
Isto é, considerando a teoria atômica como verdadeira (sendo assim, consegue-se supor o que estaria acontecendo a nível molecular e atômico).
A teoria estrutural busca explicar e sistematizar então como os elétrons mantêm esses átomos unidos, como os átomos se distribuem em uma molécula, o tamanho e a forma da molécula; para isso, levando em consideração os fatos de como o composto se comporta:
- Propriedades físicas: Ponto de fusão, de ebulição, a densidade, etc.
- Propriedades químicas: Como que o composto reage ao meio ambiente, participa de reações, velocidade de reação, etc.
Assim, no fim, pode-se então definir todas essas características sobre um composto pelo processo contrário.
Olhando a fórmula estrutural e determinar as propriedades dele.
Primeiramente, começa-se a analisar um composto pela fórmula estrutural através das ligações químicas que ele faz (força que mantém os átomos ligados uns aos outros).
Essas ligações ocorrem para atingir a camada exterior completa (se completa com 8 elétrons), ficando com a configuração eletrônica então estável como os gases nobres.
Isso serve tanto para ligações iônicas quanto covalentes, todos os átomos ficam com tendência a se ligarem até completarem a sua última camada.
Orbitais
Por mais que a mecânica quântica calculou por expressões matemáticas a quantidade de elétrons e suas energias que diferenciam a cada camada, afirmando que todos os átomos seguem um único princípio racional, ela não foi capaz de determinar onde esses elétrons realmente se encontram em um átomo, por isso sendo impossível descrever para eles uma trajetória (órbita).
Só se sabe que orbital é a região ao redor do núcleo onde determinado elétron de uma certa camada é mais provável de estar.
Dependendo então do nível e do subnível que o elétron faz parte (sua energia), resultando em um campo de influência, em um orbital, de forma e tamanho diferente.
Existindo então diferentes quantidades de energia para os elétrons possuírem em uma mesma camada, existem diferentes tipos de orbitais.
É necessário saber a forma e a posição do orbital por ser por ele que se consegue saber a estrutura (a forma) com que os átomos vão estar arranjados na molécula.
Sendo assim os orbitais responsáveis pela estrutura e consequentemente pelo comportamento que o composto apresenta.
Para uma introdução sobre orbitais: Clique Aqui.
O subnível de energia mais baixo é o s, portanto o nível de energia mais baixo é o 1s.
É a área onde provavelmente o elétron com a menor quantidade de energia nessa camada (camada 1) vai estar ocupando.
O orbital 1s é então uma esfera com o centro sendo o núcleo, esses elétrons dessa quantidade de energia podem estar em qualquer lugar ao redor do núcleo, bem próximo a ele, 95% do tempo por exemplo.
No nível energético superior, logo após 1s, vem a segunda camada com o orbital 2s, mas como um orbital s continua sendo esférico.
A diferença é que possui mais energia, portanto consegue ficar mais afastado do núcleo (tem mais força/energia para se manter mais afastado mesmo com o núcleo carregado positivamente o atraindo) e por isso também mais instável, pois haverá redução da atração eletrostática entre eles.
O orbital 2p são 3 elipsoides (formados por pares de lobos 2px, 2pz, 2py) que formam cada um dois lobos ao redor do núcleo, lobos organizados 180 graus um do outro em relação ao núcleo.
Os 3 orbitais se cruzam entre si perpendicularmente.
São chamados de 2px, 2py e 2pz, formados por 2 lobos elipsoides em um ângulo de 180 graus entre os lobos.
Sendo então em linha reta, seguindo as retas cada um respectivas aos seus nomes: x, y ou z de um plano cartesiano. Onde elas se cruzam seria o núcleo.

Como cada par de lobos (o par 2px, ou o par 2pz, ou o par 2py) sempre poderão conter no máximo dois elétrons.
O nível 2p, por ter 3 orbitais, pode conter 6 elétrons.
Quando os orbitais estão com seus dois elétrons, esses elétrons tem que ser necessariamente de spins opostos, emparelhados.
Pois dois elétrons de spins opostos tendem a se afastar um do outro o máximo possível, conseguindo assim, mesmo que tenham cargas iguais, conviverem em um mesmo orbital.

Cada quadrado nessa figura representa um orbital, os elétrons dentro dos orbitais são representados por setas, ou para cima ou para baixo.
Quando tem dois elétrons em um orbital, por exemplo no 1s, coloca-se duas setas em direções opostas, indicando o emparelhamento dos elétrons.
Entre o nível 3 e 4 há uma inversão, que por mais que o nível 4 seja mais energético, o orbital 3d fica acima (portanto mais energético) que o subnível s do nível 4, do que o 4s (que é menos energético que o nível 3d).
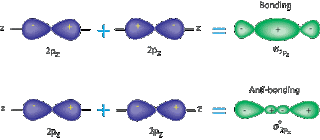
Para formar uma ligação em orbitais p, dois lobos (de diferentes átomos) contendo um único elétron, eles se sobrepõem, deixando seus spins opostos, formando assim uma ligação covalente.
Quando isso acontece, o outro lobo desse orbital que fica horizontalmente oposto ao lobo de ligação, ele fica menor e o orbital ligante fica maior (indicando assim o maior e o menor lugar de onde o elétron vai estar).
Passa-se a ter um único eixo entre os dois núcleos (que é o da ligação), essas ligações que formam esse tipo de eixo são chamadas de sigma.
Ligações pi só podem ser formadas entre orbitais p.
As ligações duplas e triplas são ligações pi, que são ligações fora do eixo de ligação entre os dois núcleos (ligação que fica no eixo é a sigma).
Então depois de uma ligação sigma já formada, se esses dois átomos ligantes tiverem um outro par de lobos de orbital p, possuindo um único elétron (elétron desemparelhado), eles poderão formar uma ligação pi.
Mais sobre o assunto: Portal São Francisco.
Hibridização
Hibridização ocorre quando um átomo "promove" um de seus elétrons que estavam emparelhados para a formação de um novo orbital de nível superior, deixando dois orbitais desemparelhados.
Esses dois novos orbitais com elétrons desemparelhados, que poderão se ligar, farão ligações da mesma forma, portanto se o elétron transferido foi de um orbital s, 2s por exemplo, para a formação de um novo orbital 2p, eles que anteriormente tinham formatos diferentes (o s era esférico e o p tinha dois lobos elipsoides), passam a ter o mesmo formato, um formato chamado então de sp, que é uma mistura dos dois formatos antigos.

A molécula acima é um CH4, onde os orbitais de dois lobos p e o orbital esférico s do carbono, hibridizaram-se e formaram 4 orbitais iguais e elipsoides, que podem então se sobreporem ao orbital do hidrogênio, no caso.
O carbono para formar ligações sempre promove o elétron emparelhado do subnível s, formando um novo subnível p.
Assim é formado dois novos orbitais com elétrons desemparelhados, podendo formar 4 ligações que é o tanto que ele precisa para completar o octeto.
Por isso normalmente quando o carbono se liga a átomos ele hibridiza seus orbitais.
Porém ele pode não hibridizar todos esses 4 orbitais, por mais que o elétron seja promovido, os orbitais não passarão a ter, todos os quatro, a mesma quantidade de energia.
Ligações duplas e triplas ocorrem pela não hibridização de certo orbital como no caso o carbono:
Na figura acima mostra a distribuição dos elétrons do carbono nos orbitais, que acaba com dois orbitais 2p com elétrons desemparelhados (como mostrado no quadro vermelho).
Porém o carbono sofre hibridização, por precisar de mais do que duas ligações para completar o octeto e ficar estável.
A hibridização também ocorre pela promoção do seu elétron de um subnível ao outro ser possível pela diferença de energia entre os dois subníveis ser pequena.
Como mostrado na figura acima, por mais que ocorra a promoção, existe três opções para o átomo de carbono, ele pode não hibridizar todos os 4 orbitais, permanecendo 1 ou no outro caso, 2 orbitais p ainda como orbitais p (com seus dois lobos), sem hibridizar.
Exemplo hibridização sp2, juntou/hibridizou o orbital s com dois orbitais p, permanecendo 1 orbital p puro, que formará uma ligação pi.
Esses dois tipos de hibridização (deixando um ou dois dos orbitais p, puros), sp2 e sp, são os casos que ocorrem ligações múltiplas (duplas ou triplas) no carbono, pela permanecia de orbitais p com seus dois lobos.
A hibridização dos 4 orbitais como um único tipo de orbital o sp, forma uma molécula de hibridização sp3, 1 orbital s e 3 orbitais p.
Essas moléculas são sempre tetraédricas (podendo ainda ser tipos de moléculas tetraédricas piramidais ou angulares, dependendo do caso, se tiverem orbitais com elétrons livres -sem se ligarem-.
Assim empurrando os demais orbitais, como o caso da NH3 e da H2O, o N tem somente 1 orbital de elétrons livres, por isso entre os orbitais ligantes fica-se com ângulo de 107 graus, mas a água o oxigênio tem 2 orbitais de elétrons livre, então o "achatamento" dos orbitais ligantes é maior, ficando com ângulo entre eles de 104,5 graus.
Essas moléculas são exemplos de sp3, por mais que nem todos os 4 orbitais façam ligações, eles se hibridizam no mesmo formato (quantidade de energia)).
Hibridização sp2, 1 orbital s e dois orbitais p, sobrando 1 orbital p puro.
Tem sempre geometria trigonal plana, possuindo entre os orbitais ligantes angulo de um triangulo, 120 graus.
Hibridização sp, 1 orbital s e 1 orbital p, deixando puro 2 orbitais p.
Possuem geometria linear, 180 graus fazendo uma ligação sigma.

Assista aula sobre hibridização:
* Boro: Possui 5 elétrons. Distribuição 1s2, 2s2, 2p1.
1s: ↑↓
2s: ↑↓
2p: ↑_ , __ , __ .
Portanto tem um orbital p com um elétron somente, um elétron desemparelhado.
1s: ↑↓
2s: ↑_
2p: ↑_ , ↑_ , __ .
O boro promove um elétron do orbital 2s, formando mais um orbital 2p (não se emparelha elétrons, por exemplo com o elétron já desemparelhado 2p, pois pela regra de Hund todos os orbitais permanecem desemparelhados até que todos os orbitais do subnível tenham completado 1 elétron).
Sendo assim o Boro fica com 3 orbitais na última camada, todos desemparelhados, podem então fazer 3 ligações, no objetivo de fazer o maior número de ligações possíveis para tentar chegar a 8 elétrons na sua última camada.
Esses 3 orbitais por serem diferentes, se hibridizam em sp2, nesse caso 1 orbital s e dois orbitais p. (Hibridização sp2 - trigonal plana).
Dividindo suas energias e ficando de tamanhos iguais para formarem ligações iguais. Forma-se nesse caso 3 orbitais sp2.
Os três orbitais (sempre serão 3 quando ocorrer esse caso de hibridização com 1 orbital s e 2 orbitais p), eles tentarão se manter o mais afastados uns dos outros possível. Por isso formam um ângulo de 120 graus entre um e outro.
Orbitais hibridizados, sp, tem o formato de um lobo elipsoide.
* Nitrogênio: Possui 7 elétrons. Distribuição 1s2, 2s2, 2sp3.
1s: ↑↓
2s: ↑↓
2p: ↑_ , ↑_ , ↑_ .
O nitrogênio possui 4 orbitais na última camada, 3 que formarão ligações com seus elétrons desemparelhados e um completo com elétrons que não serão compartilhados.
Esse orbital completo na última camada é muito mais densamente eletrônico que pode fornecer sua carga para outros átomos e moléculas que precisem de elétrons.
Com dois elétrons juntos em uma orbital sem serem compartilhados, forma-se uma orbital que ocupa muito mais espaço/área que as outras orbitais ligantes. Achatando as ligações covalentes em uma área menor do que elas ficariam sem essa orbital.
Mudando assim o ângulo de tetraédrico (que se forma em átomos com 4 orbitais na última camada) para de uma piramide com ângulo entre as ligações de 107 graus, que é o ângulo entre as arestas de uma piramide de base triangular.
Esse caso é considerado um caso de sp3, por mais que não haja promoção de elétrons, as orbitais da última camada transformaram-se, modificando sua energia e consequente forma e distância em relação ao núcleo.
Em uma substância com moléculas de formato piramidal, mesmo em temperatura ambiente o pouco movimento das partículas e choques entre si, gera energia suficiente para ocasionar inversão nas moléculas piramidais.
Para ocorrer essa inversão na molécula de amoníaco (NH3, ou amônia) precisa-se somente de 25 kJ/mol, que quando gerado elas gastam, causando sua inversão (se volta do avesso).

* H2O: Também é uma molécula com hibridização dos seus orbitais ligantes sp3.
Pois o oxigênio possui 4 orbitais na última camada, mas somente dois orbitais com elétrons desemparelhados (que farão ligação sobrepondo-se ao orbitais com também só um elétron do átomo de hidrogênio, no caso).
As outras orbitais, as orbitais completas da ultima camada do oxigênio, que não precisaram realizar ligações para conseguirem dois elétrons emparelhados, ocupam mais espaço.
Esses pares de elétrons livres (são chamados assim, pois ocupam a mesma orbital e não realizam ligação) empurram os orbitais de ligação, distorcendo a molécula, deixando-a com um ângulo de 104 graus entre essas ligações com os Hidrogênios (e não 180 graus como seria de se esperar).
A água também apresenta certa basicidade como o amoníaco, porém não tão acentuada.
A basicidade se deve aos pares de elétrons libertos que possui o oxigênio e o nitrogênio (que não fazem ligação).
Pois base de acordo com a teoria de Lewis é aquele composto que pode ceder elétrons (e ácido é o que pode ganhar elétrons), tendo então pares de elétrons livres, densamente eletronegativos, bases podem fornecer sua carga negativa a outras moléculas que se aproximarem precisando de elétrons, que puderem aceitar elétrons -aceitar carga negativa- (que são os ácidos).











0 comentários:
Postar um comentário